Koordination: Prof. Dr. rer. nat. Manja Wobus und Dr. med. Daniel Sasca
Ziele der Arbeitsgruppe Grundlagenforschung
Myelodysplastische Neoplasien (MDS) sind heterogene maligne Erkrankungen des Knochenmarks, die durch eine gestörte Blutbildung mit peripheren Zytopenien und einem deutlich erhöhten Risiko für die Transformation in eine akute myeloische Leukämie (AML) gekennzeichnet sind. In den vergangenen Jahren haben Erkenntnisse über rekurrente genetische Mutationen wesentlich zum besseren Verständnis der molekularen Ursachen von MDS beigetragen. Dennoch fehlen weiterhin zentrale Einblicke in die Mechanismen der Krankheitsentstehung, in funktionelle Konsequenzen dieser Mutationen sowie in therapeutisch nutzbare Zielstrukturen.
Eine besondere Rolle spielt die dysregulierte Transkription in MDS-Stammzellen. Sie beeinflusst grundlegende Programme der Selbsterneuerung, Differenzierung und Zellsterben und trägt wesentlich zur Progression der Erkrankung sowie zur Entwicklung von Therapieresistenzen bei.
Auch die Knochenmarknische – die unmittelbare Mikroumgebung der hämatopoetischen Stammzellen – ist von entscheidender Bedeutung. Sie besteht aus Stromazellen, Endothelzellen und Immunzellen sowie aus extrazellulären Bestandteilen wie Matrixmolekülen und löslichen Faktoren. Unter physiologischen Bedingungen reguliert die Nische die Funktion hämatopoetischer Stamm- und Vorläuferzellen. Bei malignen Transformationen oder unter Stress wird sie jedoch umprogrammiert, was sowohl die Krankheitsentwicklung als auch das Ansprechen auf Therapien beeinflussen kann.
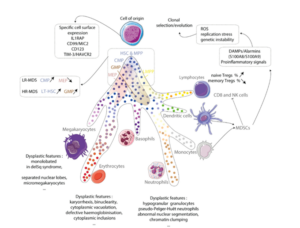
Abbildung 1: MDS geht von einer klonalen hämatopoetischen Stammzelle aus. Diese Zelle exprimiert spezifische Oberflächenmarker und treibt eine myeloide Hämatopoese auf Kosten der lymphoiden Linie voran. Die hämatopoetischen Stamm- und Vorläuferkompartimente sind gestört und produzieren dysplastische Megakaryozyten, Erythroblasten und Granulozyten. In der entzündlichen Mikroumgebung tragen vor allem myeloid-derived suppressive Zellen (MDSCs) durch die Produktion von Alarminen zur ROS-Erzeugung, zum Replikationsstress und zur genetischen Instabilität bei, wodurch die klonale Evolution forciert wird. IL1RAP: IL-1-Rezeptor-Accessory-Protein; TIM-3/HAVCR2: T-Zell-Immunglobulin-Mucin-3/Hepatitis-A-Virus-Zellrezeptor 2; LR-MDS: MDS mit niedrigem Risiko; HR-MDS: MDS mit hohem Risiko; HSC: hämatopoetische Stammzellen; LT-HSC: langfristige hämatopoetische Stammzellen; MPP: multipotente Progenitoren; CMP: common myeloid progenitor; GMP: granulocytic myeloid progenitor; MEP: megakaryocytic-erythroid progenitor; Treg: regulatorische T-Zellen; NK: natürliche Killer; ROS: reaktive Sauerstoffspezies; DAMPs: damage-associated molecular patterns. (Fontenay, M.; Farhat, B.; Boussaid, I. Pathophysiology of Myelodysplastic Syndromes. Hemato 2021, 2, 477–495. https://doi.org/ 10.3390/hemato2030030)
Die Arbeitsgruppe „Grundlagenforschung“ befasst sich mit zwei zentralen Fragestellungen:
- Der klonalen Zusammensetzung des Knochenmarks bei MDS-Patient:innen sowie den molekularen und zellulären Interaktionen mit der Knochenmarknische.
- Der molekularen Pathogenese des MDS, insbesondere der epigenetischen und Transkriptionsmechanismen, die Krankheitsentstehung, Progression und Therapieresistenz steuern.
Zur Beantwortung dieser Fragen nutzt die Arbeitsgruppe moderne 2D- und 3D-in-vitro-Modelle sowie verschiedene in-vivo-Mausmodelle. Ergänzend kommen hochauflösende Multi-Omics-Technologien zum Einsatz, um MDS-spezifische mechanistische und funktionelle Zusammenhänge systematisch zu untersuchen. Die räumliche Organisation und zellulären Interaktionen im Knochenmark werden mit modernsten bildgebenden Verfahren analysiert.
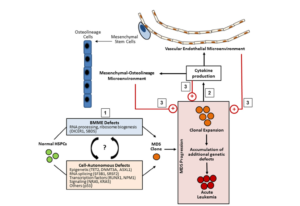
Abbildung 2: Die Rolle der Knochenmarknische in der MDS-Pathogenese. (1) Defekte in der Nische (BMME) können die Entwicklung von klonalen MDS-Zellen auslösen oder mit intrinsischen hämatopoetischen Defekten zusammenwirken. Wenn sich die MDS-Zellen ausbreiten, akkumulieren sie zusätzliche genetische Defekte, die schließlich zur Entwicklung einer akuten Leukämie führen können. (2) Während dieses Prozesses sezernieren MDS-Zellen Zytokine, die die mesenchymale osteogene Linie und die vaskuläre endotheliale Mikroumgebung verändern. (3) Die veränderte Nische sowie die autokrine Signalübertragung der sezernierten Zytokine fördern das weitere Fortschreiten der Krankheit. (Li, A. J.; Calvi, L. M. The microenvironment in myelodysplastic syndromes: Niche-mediated disease initiation and progression. Experimental hematology 2017, 55, 3–18. https://doi.org/10.1016/j.exphem.2017.08.003)
Bei Anfragen, Projektvorschlägen oder Kooperationswünschen wenden Sie sich gerne an:
Prof. Dr. rer. nat. Manja Wobus
Universitätsklinikum Carl Gustav Carus an der Technischen Universität Dresden Medizinische Klinik 1, Stammzelllabor 2, MTZ
Telefon: 0351 458-4765, -6610
Email: Manja.Wobus@ukdd.de
Dr. med. Daniel Sasca
Universitätsmedizin Mainz III. Medizinische Klinik und Poliklinik Hämatologie und Onkologie
Email: Daniel.Sasca@unimedizin-mainz.de


